Bệnh lý thần kinh thính giác (auditory neuropathy AN)
Post date: 11/10/2022
Bệnh lý mất thính giác từ từ âm thầm cả hai bên tai, không có khả năng phục hồi.
Để dễ hiểu hơn thì có thể mô tả như sau:
Bệnh thần kinh thính giác là một chứng rối loạn thính giác, trong đó tai trong phát hiện và nhận biết thành công âm thanh, nhưng lại gặp vấn đề với việc truyền âm thanh từ tai đến não. Nó có thể ảnh hưởng đến mọi người ở mọi lứa tuổi, từ trẻ sơ sinh đến tuổi trưởng thành. Bệnh diễn ra ở cả hai tai và mất thính lực từ nhẹ đến nặng. Hiện nay, chưa thống kê rõ số lượng người bị ảnh hưởng bởi bệnh thần kinh thính giác, nhưng thông tin hiện tại cho thấy rằng bệnh thần kinh thính giác đóng một vai trò quan trọng trong việc suy giảm thính lực và điếc.
Khi kiểm tra độ nhạy thính giác, những người bị bệnh thần kinh thính giác có thể có thính giác bình thường hoặc mất thính lực từ nhẹ đến nặng. Họ luôn có khả năng nhận thức lời nói kém, có nghĩa là họ khó hiểu lời nói một cách rõ ràng. Những người bị bệnh thần kinh thính giác bị suy giảm khả năng nhận thức giọng nói nhiều hơn so với được dự đoán trong các bài test kiểm tra thính lực. Ví dụ, một người bị bệnh thần kinh thính giác có thể nghe thấy âm thanh, nhưng vẫn gặp khó khăn trong việc nhận ra các từ đã nói. Âm thanh có thể mờ dần đi hoặc có vẻ không đồng bộ đối với những người này.
Các nhà nghiên cứu báo cáo một số nguyên nhân gây ra bệnh thần kinh thính giác. Trong một số trường hợp, nguyên nhân có thể liên quan đến tổn thương các tế bào lông bên trong — các tế bào lông là các tế bào cảm giác chuyên biệt ở tai trong truyền thông tin về âm thanh qua hệ thần kinh đến não. Trong các trường hợp khác, nguyên nhân có thể liên quan đến tổn thương các tế bào thần kinh thính giác truyền thông tin âm thanh từ các tế bào lông bên trong đến não. Các nguyên nhân có thể khác có thể bao gồm thừa hưởng các gen đột biến hoặc bị tổn thương hệ thống thính giác, một trong hai nguyên nhân này có thể dẫn đến kết nối bị lỗi giữa các tế bào lông trong và dây thần kinh thính giác (dây thần kinh dẫn từ tai trong đến não) hoặc tổn thương chính dây thần kinh thính giác. Sự kết hợp của những vấn đề này có thể xảy ra trong một số trường hợp.
Mặc dù tế bào lông bên ngoài - tế bào lông bên cạnh và nhiều hơn tế bào lông bên trong - thường dễ bị tổn thương hơn tế bào lông bên trong, tế bào lông bên ngoài dường như hoạt động bình thường ở những người mắc bệnh thần kinh thính giác.
Người lớn cũng có thể phát triển bệnh thần kinh thính giác cùng với mất thính giác do tuổi tác - điếc tuổi già.
Bệnh lý thần kinh thính giác xảy ra trong một số gia đình và trong một số trường hợp, các nhà khoa học đã xác định được các gen có đột biến làm ảnh hưởng đến khả năng truyền thông tin âm thanh đến não của tai. Như vậy, việc di truyền gen đột biến cũng là một yếu tố nguy cơ dẫn đến bệnh lý thần kinh thính giác.
Một số người bị bệnh thần kinh thính giác bị rối loạn thần kinh cũng gây ra các vấn đề bên ngoài hệ thống thính giác. Ví dụ về các rối loạn như vậy là hội chứng Charcot-Marie-Tooth và chứng mất điều hòa Friedreich.
Các triệu chứng của bệnh thần kinh thính giác khác nhau ở mỗi người, cùng một triệu chứng thì biểu hiện có thể khác nhau. Các triệu chứng có thể bao gồm:
Thông thường, một người bị bệnh thần kinh thính giác có một số tế bào lông hoạt động bình thường .
Dấu hiệu của bệnh lý thần kinh thính giác là không có hoặc rất bất thường về chỉ số ABR cùng với chỉ số OAE bình thường.
Chỉ số OAE bình thường nghĩa là một dấu hiệu cho thấy các tế bào lông bên ngoài đang hoạt động bình thường.
Thử nghiệm ABR và OAE không gây đau đớn và có thể được sử dụng cho trẻ sơ sinh và trẻ sơ sinh cũng như trẻ lớn hơn và người lớn. Các bài kiểm tra khác cũng có thể được sử dụng như một phần của quá trình đánh giá toàn diện khả năng nghe và nhận thức giọng nói của một cá nhân.
Các bài kiểm tra thính giác khác - chẳng hạn như nhận dạng giọng nói. Nói chung, một người bị bệnh thần kinh thính giác hoạt động kém khi xét nghiệm được đưa ra với tiếng ồn xung quanh.
Các xét nghiệm và thăm khám khác - để loại trừ các tình trạng khác có thể gây ra các triệu chứng tương tự, chẳng hạn như bệnh đa xơ cứng.
Các lựa chọn điều trị cho bệnh thần kinh thính giác bao gồm:
Ốc tai điện tử - một thiết bị được cấy ghép trong phẫu thuật để kích thích các dây thần kinh của tai trong. Những bộ phận cấy ghép này đã được chứng minh là giúp nhiều người bị tình trạng này cải thiện khả năng hiểu lời nói của họ.
Hệ thống điều tần (FM) - bộ thu di động và tai nghe khuếch đại âm thanh mà không cần đi dây
Máy trợ thính - để khuếch đại tất cả âm thanh. Nói chung, người lớn mắc bệnh thần kinh thính giác không thấy máy trợ thính đặc biệt hữu ích.
Lĩnh vực y tế được phân chia về cách dạy trẻ mắc bệnh thần kinh thính giác giao tiếp. Một trường phái tư tưởng ủng hộ việc dạy ngôn ngữ ký hiệu cho trẻ em; nhóm còn lại gợi ý rằng đứa trẻ nên được trang bị các thiết bị (chẳng hạn như máy trợ thính) và được hỗ trợ để học nghe và nói. Một số chuyên gia y tế tin rằng kết hợp cả hai cách tiếp cận là tốt nhất, vì không có cách nào để biết liệu thính giác của trẻ sẽ cải thiện, giữ nguyên hay xấu đi.
Tiếp xúc với ngôn ngữ nói rất quan trọng trong trường hợp thính giác của trẻ được cải thiện. Đối với người lớn đã có kỹ năng ngôn ngữ nói, học cách sử dụng các dấu hiệu bổ sung như đọc môi có thể hữu ích.
Viết bởi: Bs. Nguyễn Thị Ngọc Minh
Nguồn
Bệnh thần kinh thính giác là gì?
Bệnh lý thần kinh thính giác (auditory neuropathy AN) được định nghĩa một cách khái quát về mặt giải phẫu là tình trạng mất thính giác do tổn thương hoặc bất sản phần thính giác của dây thần kinh thứ tám, nằm giữa tai trong (ốc tai-D ) và thân não. Đây là một hội chứng chồng chéo giữa chuyên khoa tai và thần kinh học, vì nó gây ra các triệu chứng mà các bác sĩ tai mũi họng quan tâm (mất thính lực), nhưng lại gây ra bởi một căn bệnh mà các bác sĩ thần kinh quan tâm (tổn thương thần kinh). Một từ viết tắt liên quan, auditory neuropathy spectrum disorder ANSD - rối loạn phổ bệnh lý thần kinh thính giác - là một phiên bản ít được xác định rõ hơn của Bệnh lý thần kinh thính giác - auditory neuropathy - AN.
Để dễ hiểu hơn thì có thể mô tả như sau:
Bệnh thần kinh thính giác là một chứng rối loạn thính giác, trong đó tai trong phát hiện và nhận biết thành công âm thanh, nhưng lại gặp vấn đề với việc truyền âm thanh từ tai đến não. Nó có thể ảnh hưởng đến mọi người ở mọi lứa tuổi, từ trẻ sơ sinh đến tuổi trưởng thành. Bệnh diễn ra ở cả hai tai và mất thính lực từ nhẹ đến nặng. Hiện nay, chưa thống kê rõ số lượng người bị ảnh hưởng bởi bệnh thần kinh thính giác, nhưng thông tin hiện tại cho thấy rằng bệnh thần kinh thính giác đóng một vai trò quan trọng trong việc suy giảm thính lực và điếc.
Khi kiểm tra độ nhạy thính giác, những người bị bệnh thần kinh thính giác có thể có thính giác bình thường hoặc mất thính lực từ nhẹ đến nặng. Họ luôn có khả năng nhận thức lời nói kém, có nghĩa là họ khó hiểu lời nói một cách rõ ràng. Những người bị bệnh thần kinh thính giác bị suy giảm khả năng nhận thức giọng nói nhiều hơn so với được dự đoán trong các bài test kiểm tra thính lực. Ví dụ, một người bị bệnh thần kinh thính giác có thể nghe thấy âm thanh, nhưng vẫn gặp khó khăn trong việc nhận ra các từ đã nói. Âm thanh có thể mờ dần đi hoặc có vẻ không đồng bộ đối với những người này.
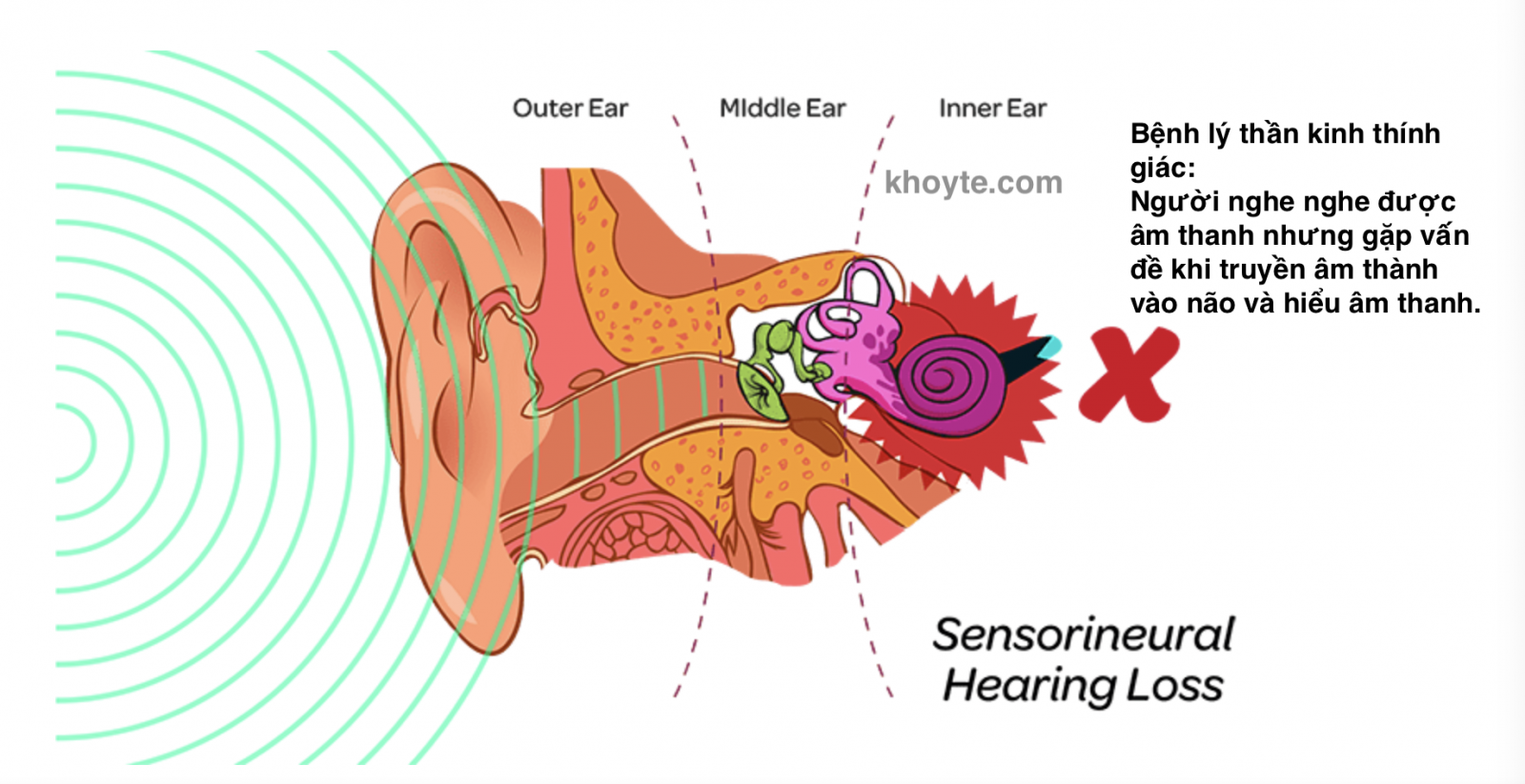
Nguyên nhân nào gây ra bệnh thần kinh thính giác?
Các nhà nghiên cứu báo cáo một số nguyên nhân gây ra bệnh thần kinh thính giác. Trong một số trường hợp, nguyên nhân có thể liên quan đến tổn thương các tế bào lông bên trong — các tế bào lông là các tế bào cảm giác chuyên biệt ở tai trong truyền thông tin về âm thanh qua hệ thần kinh đến não. Trong các trường hợp khác, nguyên nhân có thể liên quan đến tổn thương các tế bào thần kinh thính giác truyền thông tin âm thanh từ các tế bào lông bên trong đến não. Các nguyên nhân có thể khác có thể bao gồm thừa hưởng các gen đột biến hoặc bị tổn thương hệ thống thính giác, một trong hai nguyên nhân này có thể dẫn đến kết nối bị lỗi giữa các tế bào lông trong và dây thần kinh thính giác (dây thần kinh dẫn từ tai trong đến não) hoặc tổn thương chính dây thần kinh thính giác. Sự kết hợp của những vấn đề này có thể xảy ra trong một số trường hợp.
Nêu vai trò của tế bào lông ngoài và tế bào lông trong?
Các tế bào lông ngoài giúp khuếch đại các rung động âm thanh đi vào tai trong từ tai giữa. Khi thính giác hoạt động bình thường, các tế bào lông bên trong chuyển đổi những rung động này thành tín hiệu điện truyền đi dưới dạng các xung thần kinh đến não, nơi não giải thích các xung động dưới dạng âm thanh.Mặc dù tế bào lông bên ngoài - tế bào lông bên cạnh và nhiều hơn tế bào lông bên trong - thường dễ bị tổn thương hơn tế bào lông bên trong, tế bào lông bên ngoài dường như hoạt động bình thường ở những người mắc bệnh thần kinh thính giác.
Có các yếu tố nguy cơ của bệnh thần kinh thính giác không?
Ở trẻ em.- Có một số cách mà trẻ em có thể mắc phải bệnh thần kinh thính giác. Một số trẻ em được chẩn đoán mắc bệnh thần kinh thính giác đã gặp phải các vấn đề sức khỏe cụ thể trước hoặc trong khi sinh hoặc khi mới sinh. Những vấn đề này bao gồm:
- cung cấp oxy không đầy đủ trong hoặc trước khi sinh,
- Sinh non,
- Vàng da,
- Nhẹ cân
- Thiếu hụt thiamine - vitamin B1 chế độ ăn uống.
Người lớn cũng có thể phát triển bệnh thần kinh thính giác cùng với mất thính giác do tuổi tác - điếc tuổi già.
Bệnh lý thần kinh thính giác xảy ra trong một số gia đình và trong một số trường hợp, các nhà khoa học đã xác định được các gen có đột biến làm ảnh hưởng đến khả năng truyền thông tin âm thanh đến não của tai. Như vậy, việc di truyền gen đột biến cũng là một yếu tố nguy cơ dẫn đến bệnh lý thần kinh thính giác.
Một số người bị bệnh thần kinh thính giác bị rối loạn thần kinh cũng gây ra các vấn đề bên ngoài hệ thống thính giác. Ví dụ về các rối loạn như vậy là hội chứng Charcot-Marie-Tooth và chứng mất điều hòa Friedreich.
Các triệu chứng của bệnh thần kinh thính giác
Các triệu chứng của bệnh thần kinh thính giác khác nhau ở mỗi người, cùng một triệu chứng thì biểu hiện có thể khác nhau. Các triệu chứng có thể bao gồm:
- Mất thính lực từ nhẹ đến nặng, thường bị cả hai tai.
- Âm thanh mờ dần trong và ngoài
- Khó hiểu các từ đã nói (nhận thức giọng nói)
- Thính giác bình thường nhưng nhận thức giọng nói kém
- Nhận thức giọng nói kém hơn trong môi trường ồn ào.
- Nhiều triệu chứng của bệnh thần kinh thính giác cũng có thể do các dạng mất thính lực phổ biến hơn gây ra.
Bệnh thần kinh thính giác được chẩn đoán như thế nào?
Các chuyên gia y tế — bao gồm bác sĩ tai mũi họng (bác sĩ tai, mũi và họng), bác sĩ nhi khoa và bác sĩ thính học — sử dụng kết hợp các phương pháp để chẩn đoán bệnh thần kinh thính giác. Chúng bao gồm các bài kiểm tra:Phản ứng thân não thính giác (ABR):
sử dụng các điện cực đăt trên tai và đầu để theo dõi hoạt động của sóng não phản ứng với âm thanh. Bình thường não phát hiện các mẫu sóng não khi người đó tiếp xúc với một loạt âm thanh.
Thông thường, khi một người bị bệnh thần kinh thính giác có ít hoặc không có phản ứng phát xạ âm thanh.
Phát xạ âm thanh (OAE):
Một micrô nhỏ nhạy được đặt bên trong ống tai để kiểm tra xem các tế bào lông ốc tai có hoạt động hay không.Nếu vậy, micrô sẽ thu những âm thanh yếu ớt do các sợi lông tạo ra khi chúng phản ứng với tiếng ồn.Thông thường, một người bị bệnh thần kinh thính giác có một số tế bào lông hoạt động bình thường .
Dấu hiệu của bệnh lý thần kinh thính giác là không có hoặc rất bất thường về chỉ số ABR cùng với chỉ số OAE bình thường.
Chỉ số OAE bình thường nghĩa là một dấu hiệu cho thấy các tế bào lông bên ngoài đang hoạt động bình thường.
Thử nghiệm ABR và OAE không gây đau đớn và có thể được sử dụng cho trẻ sơ sinh và trẻ sơ sinh cũng như trẻ lớn hơn và người lớn. Các bài kiểm tra khác cũng có thể được sử dụng như một phần của quá trình đánh giá toàn diện khả năng nghe và nhận thức giọng nói của một cá nhân.
Các bài kiểm tra thính giác khác - chẳng hạn như nhận dạng giọng nói. Nói chung, một người bị bệnh thần kinh thính giác hoạt động kém khi xét nghiệm được đưa ra với tiếng ồn xung quanh.
Các xét nghiệm và thăm khám khác - để loại trừ các tình trạng khác có thể gây ra các triệu chứng tương tự, chẳng hạn như bệnh đa xơ cứng.
Các lựa chọn điều trị cho bệnh thần kinh thính giác
Không có cách chữa khỏi bệnh thần kinh thính giác. Bản chất thay đổi của chứng rối loạn thính giác này có nghĩa là một số phương pháp điều trị có hiệu quả trong một số trường hợp chứ không phải những trường hợp khác. Thật không may, không có thử nghiệm nào để dự đoán liệu một phương pháp điều trị cụ thể có hiệu quả hay không - bệnh nhân và bác sĩ chuyên khoa thính giác của họ có thể phải thử nghiệm để tìm hiểu.Các lựa chọn điều trị cho bệnh thần kinh thính giác bao gồm:
Ốc tai điện tử - một thiết bị được cấy ghép trong phẫu thuật để kích thích các dây thần kinh của tai trong. Những bộ phận cấy ghép này đã được chứng minh là giúp nhiều người bị tình trạng này cải thiện khả năng hiểu lời nói của họ.
Hệ thống điều tần (FM) - bộ thu di động và tai nghe khuếch đại âm thanh mà không cần đi dây
Máy trợ thính - để khuếch đại tất cả âm thanh. Nói chung, người lớn mắc bệnh thần kinh thính giác không thấy máy trợ thính đặc biệt hữu ích.
Bệnh thần kinh thính giác bao giờ trở nên tốt hơn hay tồi tệ hơn?
Một số trẻ sơ sinh được chẩn đoán mắc bệnh thần kinh thính giác sẽ cải thiện và bắt đầu nghe và nói trong vòng một hoặc hai năm. Các trẻ sơ sinh khác cũng vậy, trong khi một số trẻ nặng hơn và có dấu hiệu cho thấy các tế bào lông bên ngoài không còn hoạt động nữa (phát xạ âm thanh bất thường). Ở những người bị bệnh thần kinh thính giác, độ nhạy thính giác có thể duy trì ổn định, tốt lên hoặc xấu đi, hoặc dần dần xấu đi.
Kỹ năng giao tiếp cho người bị bệnh thần kinh thính giác
Lĩnh vực y tế được phân chia về cách dạy trẻ mắc bệnh thần kinh thính giác giao tiếp. Một trường phái tư tưởng ủng hộ việc dạy ngôn ngữ ký hiệu cho trẻ em; nhóm còn lại gợi ý rằng đứa trẻ nên được trang bị các thiết bị (chẳng hạn như máy trợ thính) và được hỗ trợ để học nghe và nói. Một số chuyên gia y tế tin rằng kết hợp cả hai cách tiếp cận là tốt nhất, vì không có cách nào để biết liệu thính giác của trẻ sẽ cải thiện, giữ nguyên hay xấu đi.Tiếp xúc với ngôn ngữ nói rất quan trọng trong trường hợp thính giác của trẻ được cải thiện. Đối với người lớn đã có kỹ năng ngôn ngữ nói, học cách sử dụng các dấu hiệu bổ sung như đọc môi có thể hữu ích.
Viết bởi: Bs. Nguyễn Thị Ngọc Minh
Nguồn
- Apostoli, P., et al. (2013). "High doses of cobalt induce optic and auditory neuropathy." Exp Toxicol Pathol 65(6): 719-727.
- Bae, S. H., et al. (2013). "Genetic analysis of auditory neuropathy spectrum disorder in the Korean population." Gene 522(1): 65-69.
- Bamiou DE, Spraggs PR, Gibberd FB, Sidey MC, Luxon LM. Hearing loss in adult Refsum's disease.Clin Otolaryngol 2003 Jun;28(3):227-30
- Bell, A. F., J. S. Atkins, et al. (1988). Sensorineural hearing loss in AIDS. Fourth International Conference on Acquired Immunodeficiency (AIDS), Stockholm.
- Belman, A. L., M. H. Ultmann, et al. (1985). "Neurological complications in infants and children with acquired immune deficiency syndrome." Annals of Neurology 18(5): 560-6.
- Berlin CI, Hood LJ, Hurley A, Wen H. Contralateral suppression of otoacoustic emissions: an index of the function of the medial oliovocochlear system. Otolaryngol HNS 1994:110:3-21
- Budenz, C. L., et al. (2013). "Speech and language outcomes of cochlear implantation in children with isolated auditory neuropathy versus cochlear hearing loss." Otol Neurotol 34(9): 1615-1621.
- Caldas, F. F., et al. (2012). "Auditory neuropathy spectrum: the importance of adequate diagnosis." Int Tinnitus J 17(2): 194-199.
- Can, E., et al. (2015). "Auditory neuropathy in late preterm infants treated with phototherapy for hyperbilirubinemia." Int J Audiol 54(2): 89-95.
- Cardon, G. and A. Sharma (2013). "Central auditory maturation and behavioral outcome in children with auditory neuropathy spectrum disorder who use cochlear implants." Int J Audiol 52(9): 577-586.
- Dean, C., et al. (2013). "Analysis of speech perception outcomes among patients receiving cochlear implants with auditory neuropathy spectrum disorder." Otol Neurotol 34(9): 1610-1614.
- Doyle KJ, Sininger Y, Starr A. Auditory neuropathy in childhood. The laryngoscope, 108:1374-1377, 1998
- El-Badry MM, Gamal R, Fawzy A.Evaluation of saccular and inferior vestibular nerve function in children with auditory neuropathy spectrum disorder.Eur Arch Otorhinolaryngol. 2018 Sep 26. doi: 10.1007/s00405-018-5149-3. [Epub ahead of print]
- Fernandes, N. F., et al. (2015). "Performance of hearing skills in children with auditory neuropathy spectrum disorder using cochlear implant: a systematic review." Braz J Otorhinolaryngol 81(1): 85-96.
- Fujikawa S, Starr A. Vestibular neuropathy accompanying auditory and peripheral neuropathies. Arch Otolaryngol HNS 2000:126:1463-1456
- Geltma, C. L. and J. E. Schupbach (1986). "Neuro-audiologic findings of a patient with acquired immune deficiency syndrome." ASHA 26: 76.
- Gibson, W. P. and H. Sanli (2007). "Auditory neuropathy: an update." Ear Hear28(2 Suppl): 102S-106S.
- Humphriss, R., et al. (2013). "Does cochlear implantation improve speech recognition in children with auditory neuropathy spectrum disorder? A systematic review." Int J Audiol 52(7): 442-454.
- Jeon, J. H., et al. (2013). "Relationship between electrically evoked auditory brainstem response and auditory performance after cochlear implant in patients with auditory neuropathy spectrum disorder." Otol Neurotol 34(7): 1261-1266.
- Jeong, S. W. and L. S. Kim (2013). "Auditory neuropathy spectrum disorder: predictive value of radiologic studies and electrophysiologic tests on cochlear implant outcomes and its radiologic classification." Acta Otolaryngol 133(7): 714-721.
- Kaga, K. (2015). "Auditory nerve disease and auditory neuropathy spectrum disorders." Auris Nasus Larynx.
- Kantu, S., D. Lee, et al. (1996). "Safety awareness for the otolaryngologist caring for the HIV-positive patient." Laryngoscope 106(8): 982-6.
- Kontorinis, G., et al. (2014). "Cochlear implantation in children with auditory neuropathy spectrum disorders." Cochlear Implants Int 15 Suppl 1: S51-54.
- Korver, A. M., et al. (2012). "Auditory neuropathy in a low-risk population: a review of the literature." Int J Pediatr Otorhinolaryngol 76(12): 1708-1711.
- Kraus N, Ozdamar O, Stein L, Reed N. Absent auditory brain stem response: peripheral hearing loss or brain stem dysfunction. Laryngoscope 1984:94:400-6
- Lepcha, A., et al. (2015). "Neurological associations in auditory neuropathy spectrum disorder: Results from a tertiary hospital in South India." Ann Indian Acad Neurol 18(2): 171-180.
- Liang F et al. Auditory neuropathy: clinical study of 17 cases. ARO abstracts, 2001, #53
- McMahon CM and others. Frequency-Specific Electrocochleography Indicates that Presynaptic and Postsynaptic Mechanisms of Auditory Neuropathy Exist. Ear and Hearing 2008:29(3) 314-325
- Madden C and others. Clinical and audiological features in auditory neuropathy. Arch Otolaryngol HNS 2002:1026-30
- Maeda, Y., et al. (2015). "Steroid-dependent sensorineural hearing loss in a patient with Charcot-Marie-Tooth disease showing auditory neuropathy." Auris Nasus Larynx 42(3): 249-253.
- Matsunaga, T., et al. (2012). "A prevalent founder mutation and genotype-phenotype correlations of OTOF in Japanese patients with auditory neuropathy." Clin Genet 82(5): 425-432.
- Mittal, R., et al. (2012). "Auditory neuropathy spectrum disorder: its prevalence and audiological characteristics in an Indian tertiary care hospital." Int J Pediatr Otorhinolaryngol 76(9): 1351-1354.
- Mohammadi, A., et al. (2015). "Unilateral auditory neuropathy spectrum disorder: retrocochlear lesion in disguise?" J Laryngol Otol 129 Suppl 1: S38-44.
- Morlet, T., et al. (2014). "A homozygous SLITRK6 nonsense mutation is associated with progressive auditory neuropathy in humans." Laryngoscope 124(3): E95-103.
- Nash, R., et al. (2014). "Vestibular function in children with auditory neuropathy spectrum disorder." Int J Pediatr Otorhinolaryngol 78(8): 1269-1273.
- Nikolopoulos, T. P. (2014). "Auditory dyssynchrony or auditory neuropathy: understanding the pathophysiology and exploring methods of treatment." Int J Pediatr Otorhinolaryngol 78(2): 171-173.
- Papadakis CE, Hajiioannou JK, Kyrmizakis DE, Bizakis JG . Bilateral sudden sensorineural hearing loss caused by Charcot-Marie-Tooth disease. J Laryngol Otol 2003 May;117(5):399-401
- Pelosi, S., et al. (2012). "Stimulation rate reduction and auditory development in poorly performing cochlear implant users with auditory neuropathy." Otol Neurotol 33(9): 1502-1506.
- Pelosi, S., et al. (2013). "Cochlear implantation versus hearing amplification in patients with auditory neuropathy spectrum disorder." Otolaryngol Head Neck Surg 148(5): 815-821.
- Penido, R. C. and M. L. Isaac (2013). "Prevalence of auditory neuropathy spectrum disorder in an auditory health care service." Braz J Otorhinolaryngol 79(4): 429-433.
- Prabhu, P. (2015). "Acquired auditory neuropathy spectrum disorder after an attack of chikungunya: case study." Eur Arch Otorhinolaryngol.
- Rance, G., et al. (2014). "Auditory neuropathy in individuals with Type 1 diabetes." J Neurol 261(8): 1531-1536.
- Rance, G. and A. Starr (2015). "Pathophysiological mechanisms and functional hearing consequences of auditory neuropathy." Brain.
- Runge, C. L., et al. (2013). "A novel otoferlin splice-site mutation in siblings with auditory neuropathy spectrum disorder." Audiol Neurootol 18(6): 374-382.
- Sheykholeslami K, Kaga K, Kaga MJ Laryngol Otol 2001 Jul;115(7):530-4 An isolated and sporadic auditory neuropathy (auditory nerve disease): report of five patients.
- Sheykholeslami K, Kaga K, Murofushi T and Hughes DW (2000). "Vestibular function in auditory neuropathy." Acta Otolaryngol 120(7): 849-54.
- Silva, M. A., et al. (2015). "Molecular approach of auditory neuropathy." Braz J Otorhinolaryngol 81(3): 321-328.
- Sinha, S. K., et al. (2013). "Involvement of peripheral vestibular nerve in individuals with auditory neuropathy." Eur Arch Otorhinolaryngol 270(8): 2207-2214.
- Sinha, S. K., et al. (2013). "Vestibular test findings in individuals with auditory neuropathy: review." J Laryngol Otol 127(5): 448-451.
- Smith, T., J. Jakobsen, et al. (1988). "Clinical and electrophysiological studies of human immunodeficiency virus-seropositive men without AIDS." Annals of Neurology 23(3): 295-7.
Sooy, C. D. (1987). Impact of AIDS on otolaryngology head and neck surgery. Chicago, Year Book Medical Publishers. - Song M, Li J, Lan L, Xie L, Xiong F, Yu L, Shi W, Wang D, Guan J, Wang H, Wang Q. Clinical characteristics of patients with unilateral auditory neuropathy. Am J Otolaryngol. 2021 Jun 24;42(5):103143. doi: 10.1016/j.amjoto.2021.103143. Epub ahead of print. PMID: 34175691.
- Starr A. and others. Transient deafness due to temperature sensitive auditory neuropathy. Ear and Hearing, 1998:19:167-179
- Starr A and others. Auditory Neuropathy. Brain (1996) 119, 741-753
- Stein LK and others. Auditory neuropathy associated with elevated bilirubin levels. ARO, 1997
- Stein LK and others. Brainstem abnormalities in neonates with normal otoacoustic emissions. Seminars in Hearing, 17, 2, 1996, 197-213
- Sujeet, K. S., et al. (2014). "Cervical vestibular evoked myogenic potentials and caloric test results in individuals with auditory neuropathy spectrum disorders." J Vestib Res 24(4): 313-323.
- Tang, H. Y., et al. (2015). "DNA sequence analysis and genotype-phenotype assessment in 71 patients with syndromic hearing loss or auditory neuropathy." BMJ Open 5(5): e007506.
- Wang DY, Bu XK, Xing GQ and Lu L (2003). "[Neurophysiological characteristics of infants and young children with auditory neuropathy]." Zhonghua Yi Xue Za Zhi 83(4): 281-4.
- Wang Q, Gu R, Han D, Yang W. Familial auditory neuropathy. Laryngoscope. 2003 Sep;113(9):1623-9.
- Wong, V. (1997). "A neurophysiological study in children with Miller Fisher syndrome and Guillain-Barre syndrome." Brain Dev 19(3): 197-204.
- Zhang, J., et al. (2014). "[The curative effect analysis of combined medical therapy for auditory neuropathy spectrum disorder]." Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi 28(8): 544-547.
- Zong, L., et al. (2015). "Mutations in apoptosis-inducing factor cause X-linked recessive auditory neuropathy spectrum disorder." J Med Genet 52(8): 523-531.



